Em 1884, o médico Dinamarquês Cristian Gram descobriu, empiricamente, ao corar cortes histológicos com violeta genciana, através do método de Ehrlich (1882), que as bactérias que eles continham não eram descoradas pelo álcool, se previamente tratadas com solução de iodo. Ele adicionou a este procedimento um contra-corante (safranina, fucsina básica, etc.,) e estabeleceu, a partir dai, uma metodologia de coloração diferencial.
Ao longo destes anos, o mecanismo de coloração de Gram foi sobejamente estudado. E nesta medida, muitas modificações foram propostas, sem contudo afetar substancialmente a idéia original.
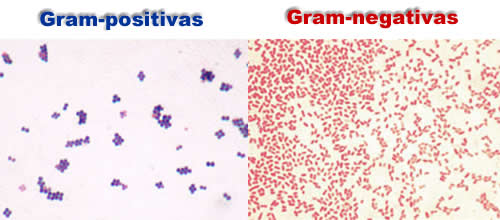
Os microrganismos respondem diferentemente ao método. Há os que retêm o pigmento característico do corante (cristal violeta) em vista da formação de um complexo com a solução iodo-iodeto (lugol), apesar da lavagem com álcool ou acetona, motivando uma desidratação da parede celular, diminuição da porosidade e da permeabilidade. São os Gram-positivos. E há os que permitem a remoção do pigmento do corante pela lavagem com álcool ou acetona, em decorrência da extração de lipídios da parede, o que leva a um aumento da porosidade celular. São os Gram-negativos. Tratando, os dois grupos, com contra-corante (safranina ou fucsina básica) observa-se que as células do primeiro (Gram-positivos) não são afetadas e permanecem azuis ou violeta; enquanto que para o outro (Gram-negativos) as células absorvem o contra-corante, tornando-as vermelhas.
A parede celular bacteriana apresenta particularidades na sua composição química. Este dado é absolutamente coincidente com a resposta à reação de Gram. A presença de maior teor de peptideoglicano nos Gram-positivos, tem sido apontada como fator determinante da retenção do complexo ao nível de parede. Tanto assim que os protoplastos, produzidos por ação de lisozima ou por efeito de penicilina sobre os Gram-positivos, não são capazes de reter o pigmento, após lavagem com álcool ou acetona. Portanto, a reação de Gram resulta essencialmente das interações do complexo, cristal violeta ou violeta de genciana e iodo, com o peptideoglicano da parede celular, numa combinação ainda não de todo esclarecida, na qual a presença de ribonucleato de magnésio é mediadora da fixação do corante.
A reação de Gram tem largo relacionamento com o estado fisiológico da célula. As culturas jovens respondem melhor à diferenciação tintorial. As culturas velhas de Gram-positivas podem se apresentar como Gram-variável, pela perda da capacidade de retenção do corante.
A coloração é hoje empregada com elevado significação taxonômica. Assim, são Gram-positivos quase todos os bacilos esporulados, móveis por flagelos peritríquios e a quase totalidade dos cocos. São Gram-negativos a quase totalidade dos bacilos não esporulados, móveis por flagelos peritríquios ou polares, e todas as espiroquetas, apenas para citar alguns exemplos.
Procedimentos da coloração de Gram
- Em uma lâmina, contendo esfregaço seco, cubra-o pingando gotas de violeta-de-metila e deixe agir por 15 segundos;
- Adicione água ao esfregaço, em cima do violeta-de-metila, cobrindo toda a lâmina. Deixe agir por mais 45 segundos;
- Após o tempo corrido, escorra o corante e lave o esfregaço em um filete de água corrente. Cubra a lâmina com lugol ou Iodo de Gram e deixe por 60 segundos;
- Escorra todo o lugol e lave em um filete de água corrente;
- Aplique álcool etílico a 95%, ou acetona, para descorar a lâmina por 10 a 20 segundos;
- Lave em um filete de água corrente;
- Cubra toda a lâmina com safarina e deixe corar por aproximadamente 30 segundos;
- Lave a lâmina em um filete de água;
- Seque a lâmina com auxílio de um papel de filtro limpo ou deixe-a secar ao ar livre;
- Aplique uma gota de óleo de imersão sobre o esfregaço e observe no microscópico com objetiva de imersão (100 X).
Os resultados após a coloração de Gram permitem classificar as bactérias em dois grupos:
Quando as estruturas celulares são cobertas pelo corante violeta-de-metila, todas se coram em roxo. Com a adição do mordente (Soluto de Lugol), ocorre à formação do complexo iodo-pararosanilina, que tem como propriedade fixar o corante primário nas estruturas coradas.
Algumas estruturas perdem a cor violeta rapidamente, quando ocorre a lavagem, com ácool etílico, enquanto outras perdem sua coloração mais devagar ou a perdem completamente. O corante safranina colore novamente as estruturas que foram descoradas.
As bactérias Gram-positivas, que têm a parede celular composta por mureína (peptídeoglicano – peptídeo de ácido n-acetil murâmico), durante o processo de descoloração com álcool etílico, retém o corante, permanecendo com a coloração conferida pelo corante primário (roxo). Já as bactérias Gram-negativas com parede celular composta predominantemente por ácidos graxos (lipopolissacarídeos e lipoproteínas), perdem o complexo iodo-pararosanilina, são incapazes de reter o violeta de Genciana, assumindo a cor do corante de fundo (vermelha).
São as diferenças da estrutura da parede bacteriana, principalmente com relação à espessura da camada de peptidoglicano, que é responsável pelo diferente comportamento das bactérias diante da coloração de Gram.
Leia também:
Referências Bibliográficas:
https://pt.wikipedia.org/wiki/Técnica_de_Gram
https://www.e-escola.pt/topico.asp?id=306&ordem=1
https://www.prof2000.pt/users/biologia/tcolgram.htm